مطالعه خوردگی اسیدی سیمان کلسیم آلومینی
مقدمه
دوام سیمان کلسیم آلومینی مثلاً IRC40 در محیط اسیدی در مقایسه با سیمان پرتلند بطور کلی خوب است زیرا در این سیمان آهک هیدراته شده آزاد وجود ندارد. این خاصیت ویژه استفاده از سیمان IRC40 را در محیط های خورنده نظیر لبنیات سازی ها، کارخانجات شیمیائی و لوله های فاضلاب توجیه می نماید.
با این حال، خوردگی می تواند روی دهد، اما تنها عمدتاً در برخی شرایط مشخص. هدف این تحقیق روشن کردن مکانیسم خوردگی اسیدی، و تعریف کردن محدوده های دوام قابل قبول برای انواع اسیدهای داده شده است.
مدل خوردگی اسیدی
خوردگی اسیدی بتن عموماً به انحلال خمیر سیمان و در نهایت انحلال دانه ها مربوط می شود. مکانیسم خوردگی اسیدی خمیر سیمان مشتمل بر سه مرحله اصلی است:
تجزیه هیدراتها، شکل گیری نمکهای اسیدی کلسیم و آلومینیم و بالاخره حل شدن این نمکها. واکنشهای شیمیائی مربوطه برای سیمان های آلومینی و سیمان پرتلند در زیر نوشته شده است:
در مورد سیمان کلسیم آلومینی، اولین واکنش تجزیه هیدرات آلومینات توسط اسید است.
در واکنش (۱) منواسید AH اسید آلومینی را از نمک کلسیم آن جدا کرده است:
(1) XCao.YAl2o3.nH2o+2XAH–>XCaA2 + 2yAl(OH)3 +(X + n – 3y)H2o
نتیجه این واکنش تشکیل نمک کلسیم CaA2 و آزاد شدن آلومینیم هیدروکسید است. آلومینیم هیدروکسید خاصیت آمفوتری دارد. لذا واکنش (۱) با حمله به آلومینیم هیدروکسید دنبال می شود که البته تنها وقتی امکان پذیر است که مقدار PH تقریباً زیر 4 باشد:
(2) 2yAl(OH)3 +6yAH –> 2yALA3 +3yH2o
یک نمک آلومینیم شکل می گیرد و آب آزاد میگردد. لذا برای تجزیه کامل هیدرات آلومینیم 2X+6Y مل اسید نوع AH لازم است.
واکنش (۲) برای آلومینیم هیدروکسید که مستقیماً در طول هیدراته شدن سیمان تشکیل می شود هم امکان پذیر است. در مورد یک سیمان پرتلند، که عمدتاً بر اساس کلسیم سیلیکات است، اولین واکنش حمله مستقیم به کلسیم هیدروکسید است، بخاطر خاصیت قلیائی بالای کلسیم هیدروکسید، این واکنش بسیار راحت اتفاق می افتد و حکایت از رفتار ضعیف سیمانهای پرتلند در محیط های اسیدی دارد.
واکنش بعدی تجزیه هیدرات سیلیکات است:
(3) XCao.YSio2.nH2o+2 XAH –> X CaA2 +2ySi(OH)4 + (x + n – 2y)H2o
نمک کلسیم تشکیل می شود و هیدروکسید سیلیس آزاد میگردد. هیدروکسید سیلیس عموماً بجز اسید هیدرو فلوریک توسط سایر اسیدها تجزیه نمی شود. بعد از این واکنشهای تجزیه، نمک هائی که تشکیل شده است بر حسب میزان قابلیت حل شدنشان حل می شوند. یک امکان دیگر تشکیل کمپلکس هیدرات های کلسیم آلومینات غیرقابل حل مطابق فرمول عمومی زیر است:
Ca2Al(OH)6+,(Xn-)m/n’{Al(OH)4–}1-m
شناخته شده ترین محصولات این گروه کلسیم منوکربو آلومینات (Xn-=c2-2) و منو سولفو آلومینات (Xn=SO2-4) هستند اما این امکان وجود دارد که محصولات تعریف شده ای از اکثر سایر آنیونها هم بوجود آید. پایداری این هیدراتهای کمپلکس بستگی به مقدار PH دارد، یا به عبارت دقیق تر به قدرت اسید و غلظت بستگی دارد. این تشکیل هیدرات با پر کردن خلل و فرج ها عموماً نرخ واکنش تجزیه را کاهش میدهد. در عین حال بعضی از این هیدراتها در حین بلوری شدن منبسط می شوند و ساختار را متلاشی می سازند. این مکانیسم تعریف پارامترهای عمده خوردگی اسیدی را ممکن می سازد:
- پایداری ترمودینامیکی فازهای اولیه
- قدرت اسید
- غلظت محلول اسید خورنده
- تخلخل
- خاصیت خنثی سازی فازهای اولیه
- قابلیت حل شدن نمکهای اسیدی تشکیل شده
- دما
چند مثال از اثر این پارامترها در این تحقیق شرح داده می شود:
تجربیات
رفتار فرمولهای سیمان کلسیم آلومینی در ۱۲ نوع اسید عمدتاً با اندازه گیری افت وزنی نمونه های آزمایشی مقایسه شده است. محیطهای اسیدی بر اساس مشخصات زیر انتخاب شده اند :
1- طبیعت آلی یا معدنی
2- قدرت اسیدیشان که با مقادیر Pk نشان داده می شود
3- قابلیت حل شدن نمکهای کلسیم و آلومینیوم آنها.
در جدول یک مقادیر ” Pk” و قابلیت حل شدن نمکهای کلسیم و آلومینیوم یازده اسید گزارش شده است.
| قابلیت حل شدن | مقادیر | اسید | |||
| Al | Ca | Pk3 | Pk2 | Pk1 | |
| V.Si.S | 374 | – | – | 7.45 | Acetic |
| – | 8.5 | 5.4 | 4.74 | 3.08 | Citric |
| V.S | 31 | – | – | 3.86 | Lactic |
| – | 29 | – | 6.07 | 1.83 | Maleic |
| i | 0.007 | – | 4.19 | 1.23 | Oxalic |
| – | 1.9 | – | 5.61 | 4.16 | Succinic |
| 699 | 745 | – | – | 0 | Hydrochloric |
| 637 | 1212 | – | – | 0 | Nitric |
| i | 18 | 12.67 | 7.21 | 2.12 | Ortho-Phosphoric |
| – | Si.S | 5.77 | 1.49 | 0.85 | Pyro-Phosphoric |
| 313 | 2.4 | – | 1.92 | 0 | Sulphoric |
i – غیرقابل محلول V.S = خيلی محلول V.Si.S= خیلی کم محلول Si.S = کمی محلول
جدول 1 از مقادیر Pk اسیدهای مورد مطالعه و قابلیت حل شدن نمکهای کلسیم و آلومینیم
اتیلن دی آمین تتراستیک اسید (EDTA) بخاطر اینکه اسید آزاد قابلیت حل شدن بسیار کمی دارد به شکل نمک سدیم استفاده شده است. EDTA بخاطر امکان تشکیل کیلیت (Chelates) خاصیت حل کردن زیادی دارد.
ملات هاى فوندو که در oc۲۰ هیدراته شده بودند (CAH10 عمدتاً شکل گرفته) و در oc ۵۰ به هیدرات مکعبی C3AH6 و آلومینیم هیدروکسید تبدیل شدند در محیطهای اسیدی مورد بررسی قرار گرفتند. نمونه های آزمایشی ۵*۲*۲ سانتیمتر در ۵۰ میلی لیتر محلول اسید فرو برده شدند. محلول دو بار در روز تازه میشد. در این شرایط، نرخ خوردگی بصورت افت وزنی نمونه های آزمایشی برحسب (تابعی از) تعداد تازه کردن های محلول تعریف شد.
پایداری ترمودینامیکی
جدول (۲) افت وزنی اندازه گیری شده پس از ۲۰ بار تازه سازی محلول روی خمیر سیمان خالص فوندو با W/C = 0.235 با 12 محلول اسیدی با غلظت 0.1 نرمال را نشان می دهد :
| F 50°C | F 20°C | |
| Acetic | 3.2 | 1.7 |
| Citric | 20.7 | 5.8 |
| Lactic | 10.7 | 5.1 |
| Maleic | 11.2 | 3.1 |
| Oxalic | -0.6 | -0.2 |
| Succinic | 0.7 | 0.9 |
| E.D.T.A.Na | 2.9 | 1.5 |
| Hydrochloric | 12.4 | 4.8 |
| Nitric | 14.9 | 4.5 |
| Ortho-Phosphoric | 1.3 | 0.6 |
| Pyro-Phosphoric | 3.6 | 2.4 |
| Sulphuric | 2.8 | 3.3 |
جدول ۲ : افت وزنی (Z) پس از ۲۰ بار تازهسازی محلول های 0.1 نرمال اسیدهای مختلف
افت وزنی برای F50°C (فوندو هیدراته شده در °C 20 به مدت ۲۹ ساعت و سپس تبدیل شده به مدت شش روز در °C 50) عموماً کمتر از مقادیری است که از °C F20 (فوندو هیدراته شده به مدت ۲۸ روز در 20°C) مشاهده شد. تخلخل باز تقریباً ۲ درصد برای F20°C و ۱۰ درصد برای F50°C است. حتی با این افزایش تخلخل پایداری ترمودینامیکی بالای هیدراتهای مکعبی C3AH6، در مقایسه با هیدرات های هگزاگونال ، نمایانگر بهبود دوام است که توسط تبدیل فراهم می شود .
قدرت اسید
اسیدهای قوی با غلظت مشخصی بسیار خورنده هستند زیرا هیدراتها را به راحتی تجزیه می کنند. از جدول ۲ چنین برداشت می شود که اسید کلریدریک و اسید نیتریک از جمله اسیدهای بسیار خورنده هستند. در عین حال اسید سولفوریک و اسید فسفریک که اسیدهای قوی ای هستند همیشه خیلی خورنده نیستند و می توان مشاهده کرد که اسیدهای آلی ضعیف نظیر سیتریک لاکتیک یا مالئیک افت وزنی زیادی را باعث شده اند. بنابراین می توان گفت که قدرت اسید در مورد خورندگی اسیدی تنها یک پارامتر ثانویه است.
غلظت اسید
شکل 1 افت های وزنی برای خمیر سیمان فوندو خالص W/C=0.235 که به مدت 28 روز در °C20 هیدراته شده است پس از ۸ بار تازه سازی اسیدها با غلظتهای N 0.01 ، N 0.1 و N را نشان می دهد.
بنابراین شدت خوردگی در ارتباط با غلظت ملی اسید مورد بررسی قرار می گیرد: کم برای 0.01N ، متوسط برای N 0.1 و قوی برای محلول های نرمال N .
در غلظتهای کم، امکان دارد بخاطر رسوب کلسیم آلومینات های کمپلکسی که در بالا شرح داده شد افزایش وزن مشاهده کنیم.
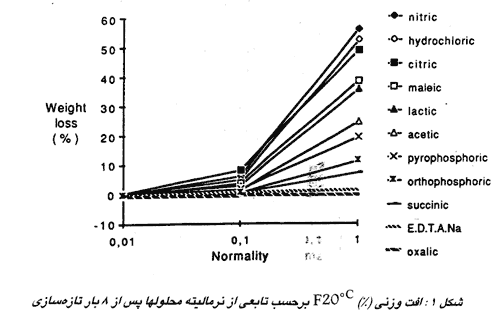
غالباً مقدار PH برای تعریف غلظت یک محلول اسیدی مورد استفاده قرار می گیرد، زیرا اندازه گیری میزان غلظت مشکل تر از اندازه گیری PH است. بنابراین تعریف محدوده های قابل قبول PH بدون خوردگی قابل ملاحظه عملاً پسندیده است.
شکل ۲ به وضوح نشان می دهد که محدوده های قابل قبول تنها برای یک اسید مورد نظر مهم است زیرا قدرت اسیدها متفاوت است. مخصوصاً جالب است ملاحظه شود که محدوده های PH برای اسیدهای قوی نظیر هیدروکلریک یا نیتریک کمتر از اسیدهای ضعیف نظیر لاکتیک یا استیک است. این را به سادگی می توان توضیح داد: برای یک غلظت مشخص محلول های اسیدهای ضعیف PH بالاتری نسبت به محلولهای اسیدهای قوی دارند. مثلاً اسید استیک 0.1N،PH 2.9 دارد در حالیکه PH اسید هیدروکلریک 0.1N یک است. لذا برای یک PH مشخصی اسیدهای قوی غلظت کمتری نسبت به اسیدهای ضعیف دارند و به همین علت می توانند کمتر خورنده باشند.
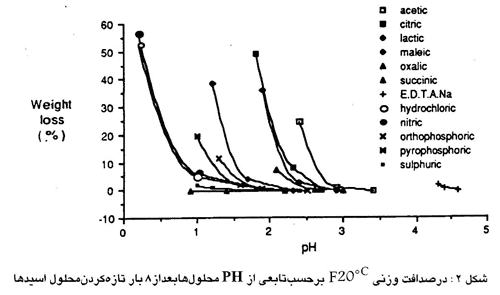
تخلخل
اهمیت تخلخل بستگی به قابلیت حل شدن نمکهائی که تشکیل می شوند دارد. این پارامتر وقتی خیلی مهم است که میزان حل شدن نمکها زیاد باشد: شکل ۳ افت وزنی ملاتهای فوندو که به مدت شش روز در °C 50 هیدراته شده اند و در محلول اسید لاکتیک 0.1 N فرو برده شده اند را نشان می دهد. با بالا رفتن نسبت آب به سیمان و در نتیجه افزایش تخلخل نرخ خوردگی به میزان قابل ملاحظهای افزایش می یابد.
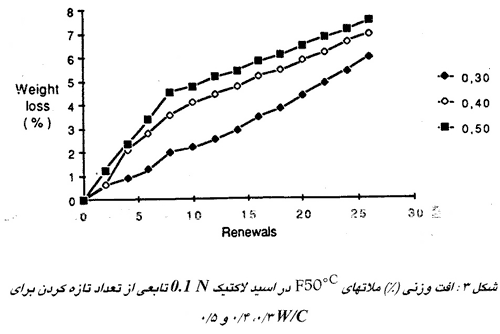
برعکس ، اگر نمک ها قابلیت حل شدن کمی داشته باشند مثل مورد اسید سولفوریک ( شکل 4 ) ، آنها در خلل و فرج بلوری شده و سطح را آب بندی میکنند. در این مورد تجزیه عملا رابطه ای با تخلخل ندارد اگر یک محدوده آب به سیمان عادی داشته باشیم.
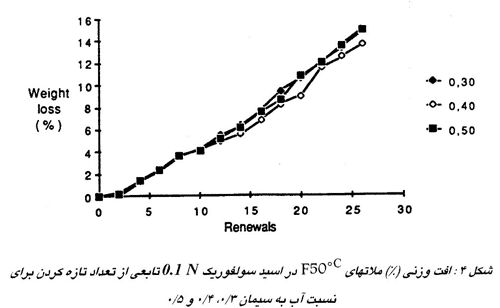
خاصیت خنثی سازی فازهای اولیه
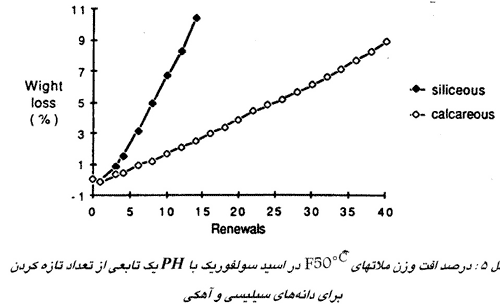
خاصیت خنثی سازی فازهای اولیه هنگامی بسیار مهم است که مقدار اسید محدود باشد، مثلاً در یک سیستم بسته. شکل ه افت وزنی ملاتهای فوندو که با دانه های سیلیسی یا آهکی ساخته شده اند و در یک محلول اسید سولفوریک با PH یک فرو برده شده اند را نشان می دهد. در این مورد دانه های کلسیم کربنات بهتر از سیلیس هستند زیرا آنها محلول اسید را خنثی می کنند و بعد از آن تجزیه خمیر سیمان کاهش می یابد. علاوه بر این سطح نمونه بطور منظم همراه با دانههای فعال حل میشود، برعکس با دانههای سيليس غیر فعال، سیمان اطراف دانه ها حل می شود و دور آنها را خالی میکند در نتیجه آنها به سرعت کنده می شوند و نرخ تجزیه را افزایش می دهند. ما این دانه های فعال را «قربانی» می نامیم زیرا آنها توسط محلولهای اسید مورد حمله قرار می گیرند و خمیر سیمان فی مابین خود را محافظت می کنند.
قابلیت حل شدن نمک ها
قابلیت حل شدن نمک هایی که تشکیل می شوند پارامتر بسیار مهمی است . مقایسه افت وزنی در جدول دو یا شکل یک با قابلیت حل شدن نمکها در جدول یک خورندگی کم اسیدهای اگزالیک، ساکسینیک، فسفریک و حتی سولفوریک را در مقایسه با اسیدهای خورنده ای نظیر سیتریک، لاکتیک، مالئیک، هیدروکلریک و نیتریک توضیح می دهند. این یک پارامتر بسیار مؤثر خوردگی اسیدی است مخصوصاً برای اسیدهای نسبتاً قوی، قابلیت حل شدن نمکهای کلسیم بسیار مهم است زیرا اولین نمکی است که طبق واکنش (۱) شکل می گیرد. نمک آلومینیم فقط در گام بعدی شکل میگیرد آنهم اگر PH باقیمانده زیر 4 باشد.
دما
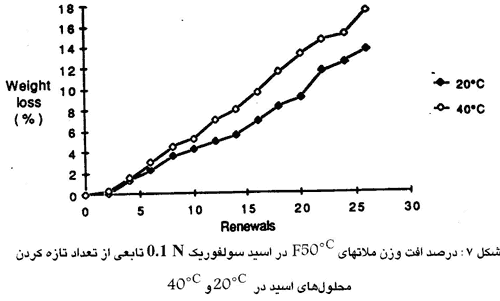
اثر دما روی ملاتهای فوندو =0.4 W/C که در محلولهای 0.1 N اسیدهای استیک لاکتیک و سولفوریک فرو برده شدند اندازه گیری شده است. همانطور که در شکل ۹ نشان داده شده است افزایش دما از “20 به 40 نرخ خوردگی اسیدهای استیک و لاکتیک را بطور قابل ملاحظه ای تغییر نمی دهد. برعکس خوردگی اسید سولفوریک حدود ۲۵ درصد افزایش می یابد. (شکل ۷) این پدیده را اینطور می توان توضیح داد که قابلیت حل شدن کلسیم سولفات با افزایش دما افزایش می یابد ،در حالی که قابلیت حل شدن کلسیم استات و ملسیم لاکتات آنقدر زیاد هست که تغییر آنها با دما اثری قابل اغماض دارد.
نتیجه گیری
خوردگی سیمانها، ملاتها و بتن های کلسیم آلومینی در محیطهای اسیدی خورنده مربوط به تجزیه هیدراتها و دانه ها می شود و بدنبال آن حل شدن نمکهائی که شکل می گیرند. پارامترهای عمده دخیل در خوردگی اسیدی عبارتند از :
- پایداری ترمودینامیکی فازهای اولیه که رفتار نسبتاً خوب فوندوی تبدیل شده را توضیح می دهد.
- قدرت اسید، که تنها یک پارامتر ثانویه است.
- غلظت اسید. که مستقیماً با شدت خوردگی ارتباط دارد.
- تخلخل، که تنها هنگامی مهم است که نمکهائی که شکل گرفته اند قابل حل باشند.
- اثر خنثی سازی فازهای اولیه، که خواص خورنده محلول اسید را کاهش می دهد.
- قابلیت حل شدن نمک ها، مخصوصاً نمک های کلسیم که مهم ترین پارامتر است.
- دما، که اثر آن تنها وقتی محسوس است که قابلیت حل شدن نمک ها کم باشد.
منبع
- J.P. BAYOUX, et al. , “ACIDIC CORROSION OF HIGH ALUMINA CEMENT” , Proceedings of the International Symposium on Calcium Aluminate Cements ,Edited by R.J. MANGABHAI 1990